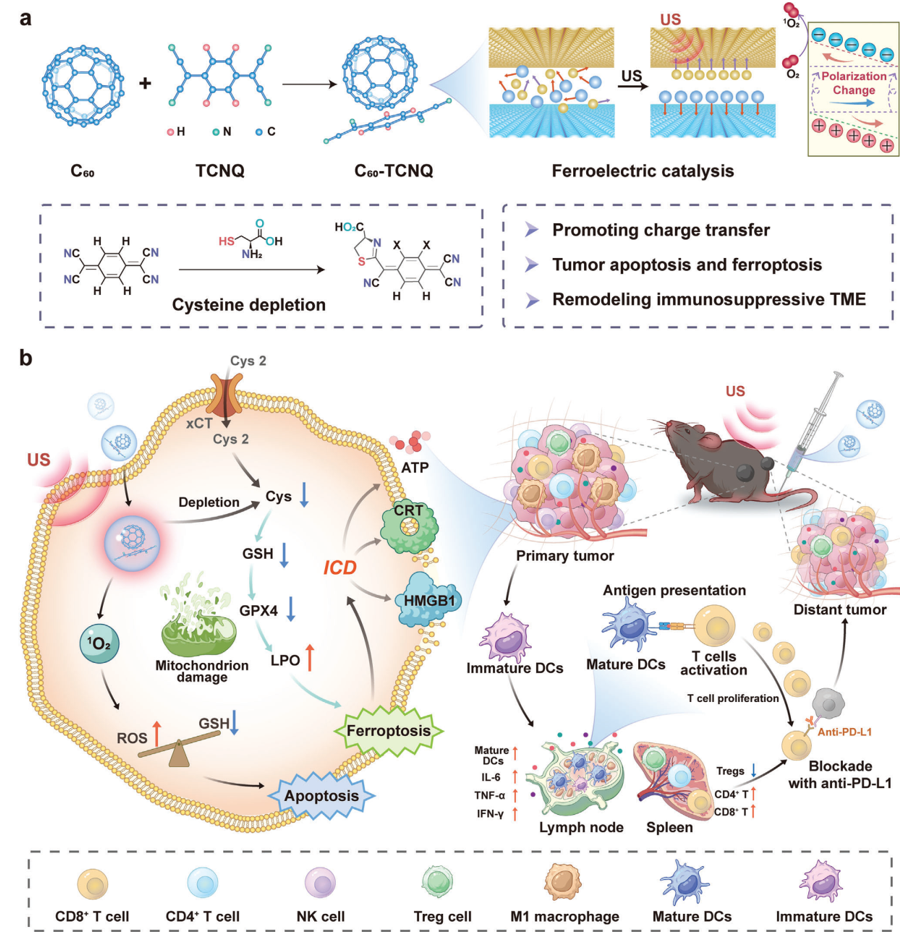
免疫原性程序性細胞死亡能夠有效地觸發(fā)急性炎癥反應,以增強抗腫瘤免疫。開發(fā)可生物降解的非金屬雙誘導劑是一種能夠增強免疫治療的重要策略。有鑒于此,復旦大學丁紅教授、上海大學陳雨教授和華東理工大學李星光研究員設計了一種可生物降解的有機分子鐵電納米平臺(C60-TCNQ,CT),其能夠?qū)崿F(xiàn)有效的鐵電催化,進而可通過誘導細胞凋亡和鐵死亡增強腫瘤免疫治療。
本文要點:
(1)CT介導的超聲觸發(fā)鐵電催化可促進鐵電極化,顯著增加活性氧的產(chǎn)生,導致大量腫瘤細胞發(fā)生凋亡。此外,CT納米顆粒的多氰基團也能夠在溫和條件下選擇性地與半胱氨酸反應,導致氧化還原失衡和脂質(zhì)過氧化物的積累,有助于誘導腫瘤細胞發(fā)生鐵死亡。研究發(fā)現(xiàn),CT誘導的細胞凋亡和鐵死亡能夠刺激免疫原性細胞死亡,進而引發(fā)強大的免疫應答。
(2)在雙側(cè)腫瘤模型中進行的體內(nèi)研究結(jié)果表明,CT可在超聲照射下增敏抗PD-L1治療,實現(xiàn)96.2%的抗惡性黑色素瘤反應率以及80%的腫瘤轉(zhuǎn)移抑制率。RNA測序分析顯示,CT治療可導致與免疫相關Jak-Stat信號通路相關的基因特征發(fā)生下調(diào)。綜上所述,該研究能夠為開發(fā)用于腫瘤免疫治療的有機分子鐵電納米藥物開辟一條新的途徑。
Huning Xu. et al. Organomolecular Ferroelectric Nanocatalyst Augments Tumor Immunotherapy by Inducing Apoptosis and Ferroptosis. Advanced Materials. 2025
DOI: 10.1002/adma.202417422
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202417422



















